Pneumonia nosocomială este cea mai frecventă și gravă infecție nosocomială, dintre care pneumonia asociată ventilatorului (PAV) reprezintă 40%. PAV cauzată de agenți patogeni refractari reprezintă încă o problemă clinică dificilă. De ani de zile, ghidurile au recomandat o serie de intervenții (cum ar fi sedarea țintită, ridicarea capului) pentru a preveni PAV, dar PAV apare la până la 40% dintre pacienții cu intubație traheală, rezultând în spitalizare mai lungă, utilizarea crescută a antibioticelor și deces. Oamenii caută întotdeauna măsuri preventive mai eficiente.
Pneumonia asociată ventilatorului (PAV) este o formă nouă de pneumonie care se dezvoltă la 48 de ore după intubația traheală și este cea mai frecventă și mortală infecție nosocomială din unitatea de terapie intensivă (UTI). Ghidurile Societății Americane de Boli Infecțioase din 2016 au distins PAV de definiția pneumoniei dobândite în spital (PAH) (PAH se referă doar la pneumonia care apare după spitalizare fără tub traheal și nu este legată de ventilația mecanică; PAV este pneumonie după intubația traheală și ventilație mecanică), iar Societatea Europeană și China consideră că PAV este încă un tip special de PAH [1-3].
La pacienții care primesc ventilație mecanică, incidența VAP variază de la 9% la 27%, rata mortalității este estimată la 13% și poate duce la creșterea utilizării sistemice a antibioticelor, ventilație mecanică prelungită, ședere prelungită la ATI și creșterea costurilor [4-6]. HAP/VAP la pacienții non-imunodeficienți este de obicei cauzată de o infecție bacteriană, iar distribuția agenților patogeni comuni și caracteristicile lor de rezistență variază în funcție de regiune, clasa spitalicească, populația de pacienți și expunerea la antibiotice și se modifică în timp. Pseudomonas aeruginosa a dominat agenții patogeni legați de VAP în Europa și America, în timp ce mai mulți Acinetobacter baumannii au fost izolați în spitalele terțiare din China. O treime până la jumătate din toate decesele legate de VAP sunt cauzate direct de infecție, rata mortalității cazurilor cauzate de Pseudomonas aeruginosa și acinetobacter fiind mai mare [7,8].
Datorită eterogenității puternice a VAP, specificitatea diagnostică a manifestărilor clinice, imagistice și a testelor de laborator este scăzută, iar gama de diagnostic diferențial este largă, ceea ce face dificilă diagnosticarea la timp a VAP. În același timp, rezistența bacteriană reprezintă o provocare serioasă pentru tratamentul VAP. Se estimează că riscul de a dezvolta VAP este de 3%/zi în primele 5 zile de utilizare a ventilației mecanice, 2%/zi între 5 și 10 zile și 1%/zi pentru restul timpului. Incidența maximă apare în general după 7 zile de ventilație, deci există o fereastră în care infecția poate fi prevenită timpuriu [9,10]. Multe studii au analizat prevenirea VAP, dar în ciuda deceniilor de cercetare și încercări de prevenire a VAP (cum ar fi evitarea intubării, prevenirea reintubării, reducerea sedării, ridicarea capului patului cu 30° până la 45° și îngrijirea orală), incidența nu pare să fi scăzut, iar povara medicală asociată rămâne foarte mare.
Antibioticele inhalatorii au fost utilizate pentru tratarea infecțiilor cronice ale căilor respiratorii încă din anii 1940. Deoarece pot maximiza livrarea medicamentelor la locul țintă al infecției (adică căile respiratorii) și pot reduce efectele secundare sistemice, au demonstrat o valoare bună de aplicare într-o varietate de boli. Antibioticele inhalatorii sunt acum aprobate de Administrația pentru Alimente și Medicamente din SUA (FDA) și de Agenția Europeană pentru Medicamente (EMA) pentru utilizare în fibroza chistică. Antibioticele inhalatorii pot reduce semnificativ încărcătura bacteriană și frecvența exacerbărilor în bronșiectazie fără a crește evenimentele adverse generale, iar ghidurile actuale le-au recunoscut ca tratament de primă linie pentru pacienții cu infecție cu pseudomonas aeruginosa și exacerbări frecvente; Antibioticele inhalatorii în perioada perioperatorie a transplantului pulmonar pot fi utilizate și ca medicamente adjuvante sau profilactice [11,12]. Dar în ghidurile VAP din SUA din 2016, experții nu aveau încredere în eficacitatea antibioticelor inhalatorii adjuvante din cauza lipsei unor studii clinice randomizate controlate de amploare. Studiul de fază 3 (INHALE) publicat în 2020 nu a reușit, de asemenea, să obțină rezultate pozitive (administrare intravenoasă de antibiotice cu amikacină inhalatorie pentru infecția bacteriană Gram-negativă cauzată de pacienți cu VAP, un studiu de fază 3, randomizat, controlat cu placebo, cu un total de 807 pacienți, medicație sistemică + inhalare asistată de amikacină timp de 10 zile).
În acest context, o echipă condusă de cercetători de la Centrul Spitalului Universitar Regional din Tours (CHRU) din Franța a adoptat o strategie de cercetare diferită și a efectuat un studiu clinic multicentric, dublu-orb, randomizat, controlat, privind eficacitatea (AMIKINHAL), inițiat de investigator. Amikacina inhalatorie sau placebo pentru prevenirea VAP a fost comparată în 19 clinici de asistență medicală combinată (UCUS) din Franța [13].
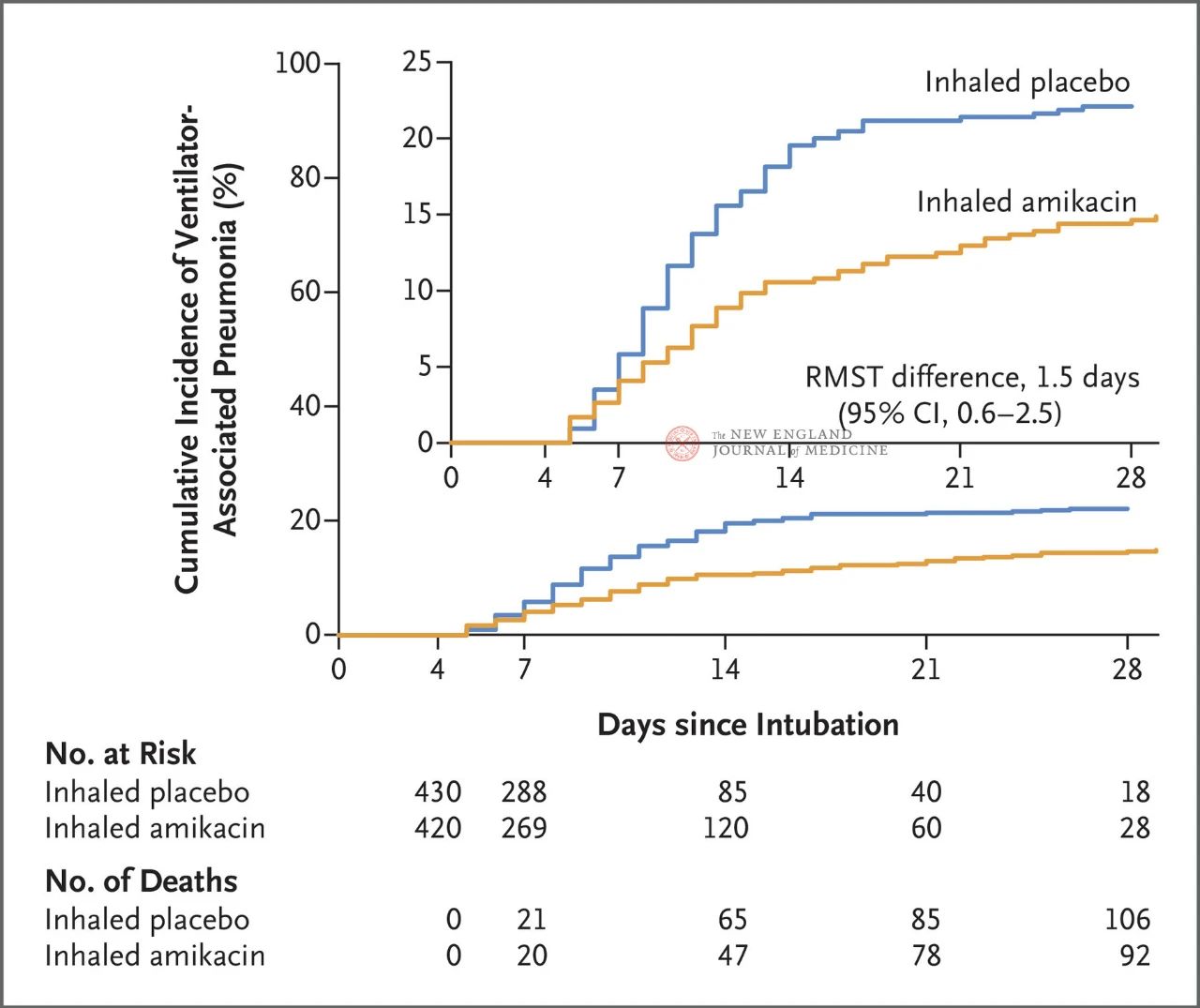
Un total de 847 de pacienți adulți cu ventilație mecanică invazivă între 72 și 96 de ore au fost repartizați aleatoriu 1:1 la administrare inhalatorie de amikacină (N = 417,20 mg/kg greutate corporală ideală, qd) sau la administrare inhalatorie de placebo (N = 430, echivalent clorură de sodiu 0,9%) timp de 3 zile. Criteriul principal de evaluare a fost primul episod de ventilație mecanică invazivă (VAP) de la începutul repartizării randomizate până în ziua 28.
Rezultatele studiului au arătat că, la 28 de zile, 62 de pacienți (15%) din grupul tratat cu amikacină au dezvoltat VAP, iar 95 de pacienți (22%) din grupul placebo au dezvoltat VAP (diferența medie limitată de supraviețuire pentru VAP a fost de 1,5 zile; IÎ 95%, 0,6~2,5; P=0,004).
În ceea ce privește siguranța, șapte pacienți (1,7%) din grupul tratat cu amikacină și patru pacienți (0,9%) din grupul placebo au prezentat evenimente adverse grave legate de studiu. Dintre cei care nu au prezentat leziuni renale acute la randomizare, 11 pacienți (4%) din grupul tratat cu amikacină și 24 de pacienți (8%) din grupul placebo au prezentat leziuni renale acute în ziua 28 (RR, 0,47; IÎ 95%, 0,23~0,96).
Studiul clinic a avut trei aspecte importante. În primul rând, în ceea ce privește designul studiului, studiul AMIKINHAL se bazează pe studiul IASIS (un studiu randomizat, dublu-orb, controlat cu placebo, de fază 2 paralelă, care a implicat 143 de pacienți). Pentru a evalua siguranța și eficacitatea tratamentului sistemic prin inhalare cu amikacină-fosfomicină al infecției bacteriene gram-negative cauzate de VAP) și studiul INHALE, care s-a încheiat cu rezultate negative, lecțiile învățate, care se concentrează pe prevenirea VAP și au obținut rezultate relativ bune. Datorită caracteristicilor de mortalitate ridicată și spitalizare lungă la pacienții cu ventilație mecanică și VAP, dacă inhalarea amikacinei poate obține rezultate semnificativ diferite în reducerea deceselor și a spitalizării la acești pacienți, aceasta va fi mai valoroasă pentru practica clinică. Cu toate acestea, având în vedere eterogenitatea tratamentului și îngrijirii tardive la fiecare pacient și la fiecare centru, există o serie de factori de confuzie care pot interfera cu studiul, astfel încât poate fi dificil să se obțină un rezultat pozitiv atribuibil antibioticelor inhalate. Prin urmare, un studiu clinic de succes necesită nu numai un design excelent al studiului, ci și selectarea unor criterii de evaluare primare adecvate.
În al doilea rând, deși antibioticele aminoglicozidice nu sunt recomandate ca medicament singular în diverse ghiduri privind VAP, acestea pot acoperi agenți patogeni comuni la pacienții cu VAP (inclusiv pseudomonas aeruginosa, acinetobacter etc.) și datorită absorbției lor limitate în celulele epiteliale pulmonare, concentrației mari la locul infecției și toxicității sistemice scăzute. Antibioticele aminoglicozidice sunt larg preferate printre antibioticele inhalatorii. Această lucrare este în concordanță cu estimarea cuprinzătoare a dimensiunii efectului administrării intratraheale a gentamicinei în probe mici, publicată anterior, care demonstrează în mod comun efectul antibioticelor aminoglicozidice inhalatorii în prevenirea VAP. De asemenea, trebuie remarcat faptul că majoritatea controalelor placebo selectate în studiile legate de antibioticele inhalatorii sunt saline normale. Cu toate acestea, având în vedere că inhalarea atomizată a salinei normale în sine poate juca un anumit rol în diluarea sputei și în a ajuta la expectorare, salina normală poate provoca anumite interferențe în analiza rezultatelor studiului, ceea ce ar trebui luat în considerare în mod cuprinzător în studiu.
În plus, adaptarea locală a medicației HAP/VAP este importantă, la fel ca și profilaxia cu antibiotice. În același timp, indiferent de durata intubației, ecologia ATI locală este cel mai important factor de risc pentru infecția cu bacterii multirezistente. Prin urmare, tratamentul empiric ar trebui să se refere pe cât posibil la datele microbiologice ale spitalelor locale și nu se poate referi orbește la ghidurile sau la experiența spitalelor terțiare. În același timp, pacienții în stare critică care necesită ventilație mecanică sunt adesea asociați cu boli multisistemice, iar sub acțiunea combinată a mai multor factori, cum ar fi starea de stres, poate exista și un fenomen de comunicare încrucișată a microbilor intestinali cu plămânii. Eterogenitatea ridicată a bolilor cauzate de suprapunerea internă și externă determină, de asemenea, că promovarea clinică la scară largă a fiecărei noi intervenții este un drum lung de parcurs.
Data publicării: 02 dec. 2023